![]()

Chapitre 4
DIFFERENCIATION ET SELECTION DES
LYMPHOCYTES T
I – Introduction
La reconnaissance des
antigènes par les lymphocytes T s’effectue au moyen de récepteurs spécifiques,
les récepteurs T (TcR), dont la diversité structurale est générée par recombinaison
somatique. A la différence des lymphocytes B dont les antigènes peuvent être
reconnus sous une forme native, les lymphocytes T reconnaissent des antigènes
sous forme peptidique et dans un contexte moléculaire particulier : les
peptides antigéniques issus de la dégradation de protéines endogènes ou
exogènes au sein de cellules dites présentatrices de l’antigène, sont présentés
aux TcR en étroite association avec des molécules hautement polymorphes codées
par des gènes du complexe majeur d’histocompatibilité (CMH). Cette capacité de
reconnaître les antigènes dans un contexte CMH est la conséquence d’un
processus sélectif intra-thymique (sélection positive), qui favorise le
développement des thymocytes capables d’interagir avec des complexes CMH-peptides
exprimés par les cellules épithéliales thymiques. C’est également ce processus
sélectif qui permettra aux cellules T d’interagir avec des antigènes associés à
des isotypes CMH de classe I ou II d’exprimer un phénotype particulier CD4 ou
CD8 et d’exercer certaines fonctions (activité auxiliaire ou cytotoxique). A ce
processus sélectif s’ajoute une élimination des thymocytes auto-réactifs
(sélection négative), conférant ainsi aux lymphocytes T la capacité de
distinguer le soi du non soi, et d’être rendus tolérants vis à vis du soi.
II – Maturation intra-thymique des lymphocytes T
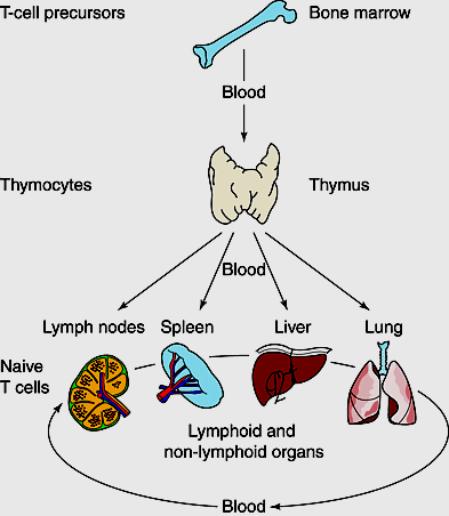
Les progéniteurs des lymphocytes T
viennent de la moelle osseuse. Ils migrent dans le thymus pour y subir une
maturation. Dans le thymus, les cellules T immatures (thymocytes) prolifèrent
et se différencient. Les étapes de la maturation des thymocytes peuvent être
suivies grâce à des marqueurs de surface. Durant leur développement, les
thymocytes réarrangent les gènes codant les chaînes du TcR. Le caractère
fonctionnel du TcR est évalué au cours des étapes de sélection positive et
négative. Les cellules T ainsi sélectionnées migrent en périphérie pour
constituer le pool des lymphocytes T matures.
Figure 1 : recirculation des lymphocytes.
B – Le thymus
L’importance du thymus dans l’immunité en général est connue de longue date. La thymectomie à la naissance induit une immunodépression sévère chez l’animal. Le rôle du thymus dans la différenciation des lymphocytes T en particulier a pu être finement étudié chez l’homme (syndrome de Di George) et chez l’animal (souris "nude") atteints d’anomalies génétiques conduisant à une absence de différenciation de l’épithélium thymique. Dans ce cas, on observe un développement normal des lymphocytes B mais une absence complète de lymphocytes T.
Le thymus est un organe bilobé logé dans le thorax à la
partie supérieure du médiastin antérieur. Chaque lobe thymique est divisé en
lobules, eux-mêmes constitués d’une zone corticale et d’une zone médullaire. La
région corticale contient de très nombreux petits thymocytes immatures formant
un réseau serré avec les cellules épithéliales corticales. On retrouve aussi à
ce niveau de nombreux macrophages. La région médullaire contient des thymocytes
matures. On y trouve aussi des cellules épithéliales médullaires, des
macrophages et des cellules dendritiques.
Figure 2 : Localisation anatomique et structure du thymus
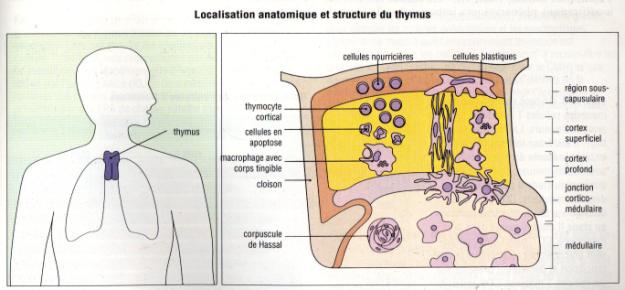
Photo : Immunologie clinique, 1991, J.
Brostoff. Ed DeBoeck Université
Les progéniteurs médullaires arrivent à la jonction
cortico-médullaire puis ils migrent vers la région sub-capsulaire où débute la
différenciation. La migration s’effectue ensuite du cortex vers la médullaire.
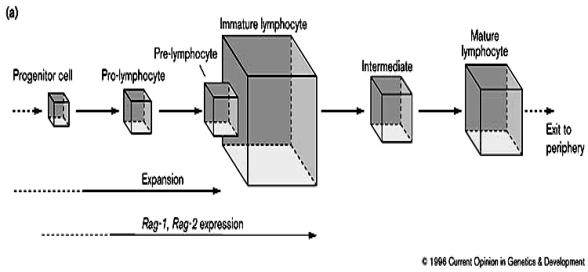
Le thymus est un lieu de prolifération intense des
thymocytes. Une seule cellule souche peut repeupler un lobe thymique entier.
Chez un souriceau nouveau-né, le thymus contient 5x108 cellules et
en produit 5x107 nouvelles par jour. Les mitoses ont lieu à deux
niveaux : au stade de prothymocytes, ce qui permet d’avoir une grande
population où les réarrangements peuvent se produire ; et au stade des
thymocytes médullaires matures juste avant le départ du thymus, permettant
l’expansion des populations cellulaires ayant un TcR fonctionnel. Seul 1
million de thymocytes matures est produit chaque jour, ce qui implique que plus
de 95% des thymocytes meurent par apoptose dans le thymus. Les cellules
apoptotiques sont rapidement éliminées dans le thymus par les macrophages
résidents.
Figure 3 : Phases d’expansion des thymocytes
C – Marqueurs de surface des thymocytes
C – 1 – Progéniteurs médullaires thymiques
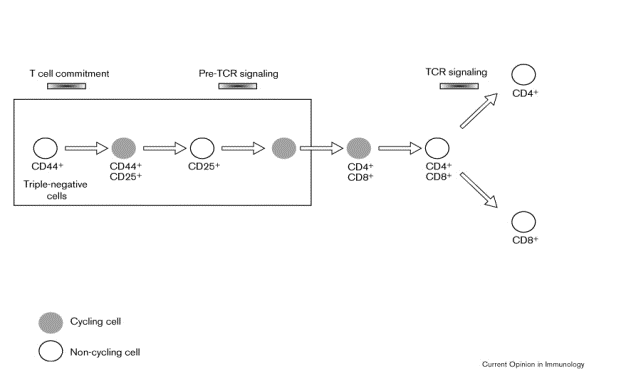
La maturation des thymocytes procède par étapes successives qui peuvent être suivies par l’expression de marqueurs de surface. La population thymique la plus immature représente 0,2% des thymocytes totaux. Ces cellules expriment faiblement le CD4, le marqueur CD44 et cKit. Après injection intraveineuse, ces cellules ont la faculté de migrer spécifiquement vers le thymus. Après injection intrathymique, ces cellules peuvent reconstituer l’ensemble des populations thymiques. Sous l’effet de signaux encore mal connus, ces thymocytes vont perdre le CD4 et devenir ainsi des thymocytes triple négatifs dont le développement peut être suivi par les marqueurs CD44, cKit et CD25.
C – 2 – Thymocytes triple négatifs
Cette population dépourvue de marqueurs CD3, CD4 et CD8, représente 1% des thymocytes totaux. Ils sont localisés dans la région subcapsulaire. A ce niveau s’opèrent, entre autres, les réarrangements des gènes b, g et d et la séparation des lignées ab et gd.
C – 2 – 1 – Prothymocytes
Les prothymocytes expriment le CD44, le CD25 et cKit. Les gènes des chaînes du TcR sont encore en configuration germinale. La commutation T s’opère à ce stade. Les prothymocytes ont un phénotype de cellule activée et sont le siège d’ une intense prolifération.
C – 2 –
2 – Préthymocytes précoces
Ces
cellules perdent les marqueurs CD44 et Ckit pour ne plus exprimer que CD25.
C’est à ce stade que s’opèrent les réarrangements de la chaîne b du TcR. 70% des cellules ne dépasseront pas ce stade.
C –2 – 3
– Préthymocytes tardifs
Lorsque la cellule a produit une chaîne b fonctionnelle, celle ci est associée en surface à la chaîne préTa. La cellule perd alors l’expression du CD25 et entre dans un état d’intense prolifération. Les thymocytes triple négatifs passent ensuite à un stade intermédiaire (immatures simple positifs) où les cellules expriment surtout le CD8 mais sans que le récepteur T ab soit exprimé.
C – 3 – Thymocytes double positifs
A partir de ce stade intermédiaire, les thymocytes expriment les marqueurs CD4 et CD8 pour devenir des thymocytes double positifs. Ces thymocytes double positifs représentent 85% des thymocytes totaux. Ils sont localisés dans la région corticale. C’est à leur niveau que débutent les réarrangements des chaînes a et la sélection du répertoire ab.
Les
thymocytes double positifs expriment initialement de faibles quantités de
récepteur T. La plupart de ces cellules expriment un récepteur incapable
d’interagir avec le CMH. Ces cellules sont éliminées au cours de la sélection
positive. Les cellules double positives qui reconnaissent le CMH continuent
leur maturation et expriment alors des niveaux élevés de TcR. Ces cellules
subissent une étape de sélection négative responsable de l’élimination des
thymocytes capables de réagir avec les constituants du soi. Ces cellules
expriment fortement le CD3 et perdent un des marqueurs CD4 ou CD8 pour devenir
des thymocytes simple positifs.
C – 4 – Thymocytes simple positifs
Les thymocytes simple positifs sont retrouvés dans la
médullaire thymique. Ils expriment de façon mutuellement exclusive les
marqueurs CD4 ou CD8. Seuls 2% des thymocytes parviennent à ce stade et sont
alors exportés en périphérie où ils constituent le répertoire périphérique des
cellules T. L’ensemble de la maturation thymique dure environ 3 semaines chez
la souris.
Figure 4 : Marqueurs de surface des thymocytes
D – Réarrangement des gènes du TcR
Les cellules T gd diffèrent des cellules ab par leur spécificité, leur niveau d’expression du CD4 et du CD8, ainsi que par leur distribution anatomique. Les deux types de cellules se distinguent aussi par leur fonction, bien que peu de choses soient connues sur le rôle exact des lymphocytes T gd. Quoiqu’il en soit, l’étude des réarrangements observés dans les thymocytes et les cellules gd et ab matures indique que ces cellules proviennent d’un progéniteur commun et que la séparation des deux lignées a lieu à un stade tardif de leur développement alors que les réarrangements des gènes ont déjà commencé. C’est ainsi que l’on peut retrouver des chaînes b réarrangées dans les lymphocytes T gd matures et que les cellules T ab contiennent fréquemment des gènes g et d réarrangés.
D - 1 – Séparation des lignées T ab et gd.
Les stades tardifs du développement T ab et gd sont distincts : en particulier, les cellules T gd ne transitent pas par un stade CD4/CD8 double positif. La façon dont s’opère la séparation des lignées T ab et gd au cours du développement reste non élucidée. Plusieurs abords de cette question ont été envisagés, les uns cellulaires, les autres moléculaires.
Les données tirées des études de
différenciation in vitro indiquent que la séparation des voies de
différenciation gd et ab surviennent tardivement, après le stadeCD4low,CD44+,
très probablement durant le stade TN CD25+. Il n’a cependant pas été possible
jusqu’à présent d’individualiser des sous-populations thymiques capables de se
différencier exclusivement en cellules T ab ou gd,
l’orientation vers l’un ou l’autre type de cellules semblant affectée par les
conditions de culture in vitro plutôt que par l’origine des cellules
précurseurs.
Un abord plus moléculaire de la
question a consisté à étudier la survenue des réarrangements gd au sein
des cellules ab et réciproquement. Cependant, aucune distinction
formelle n’a pu être établie dans le sens où la plupart des cellules T ab semblent
avoir réarrangé aussi leur gène g (et probablement d). En
outre, des réarrangements complets VDJb sont parfois retrouvés
chez des cellules T gd.
Trois modèles, dont chacun ne peut encore être exclu
formellement, sont actuellement proposés :
D – 1 –
1 – 1 – Modèle séquentiel
Selon le modèle séquentiel, les
cellules T gd se développeraient en premier, les cellules T ab étant issues
des précurseurs ayant été incapables de produire un TcR gd
fonctionnel. Ce modèle repose plus particulièrement sur la mise en évidence
d’une séquence d’activation des réarrangements gd, puis b puis a, au
cours du développement thymique fœtal chez la souris. Toutefois, cette séquence
de réarrangements n’est pas retrouvée chez les thymocytes adultes puisque, dans
ce cas, les réarrangements β, γ et δ s’effectuent en même temps.
D – 1 –
1 – 2 - Modèle compétitif
La séparation des lignées γδ et
αβ dépend de la qualité des réarrangements β, γ et δ qui surviendraient ici à
un même stade. Un réarrangement γδ précoce induirait la différenciation des
thymocytes en lymphocytes T γδ alors qu’un réarrangement productif précoce de
la chaîne β produirait des lymphocytes αβ. Toutefois, on devrait retrouver une
fréquence de lymphocytes T γδ plus élevée que celle qui est réellement
observée.
D – 1 –
1 – 3 - Modèle différentiel
La différenciation en lymphocytes T γδ ou αβ serait
liée à des propriétés préexistantes spécifiques des précurseurs thymiques.
D – 2 - Réarrangement de la chaîne β
Les premières cellules T qui
apparaissent durant le développement embryonnaire portent des récepteurs T γδ.
Chez la souris, où le développement du système immunitaire peut être étudié en
détail, les cellules T gδ apparaissent par vagues successives peuplant
différents sites histologiques de l’animal. Les cellules T αβ apparaissent
quelques jours après la première vague de cellules γδ et deviennent rapidement
les plus nombreuses. Les réarrangements des chaînes α et β durant le
développement des cellules T sont relativement semblables à ceux observés pour
les gènes d’immunoglobulines. La chaîne β se réarrange en premier. Les segments
Dβ s’associent aux segments Jβ. Cet ensemble DJβ se réarrange ensuite avec un
gène Vβ. Si aucune chaîne β fonctionnelle ne peut être synthétisée à partir des
réarrangements, la cellule ne peut exprimer de pré TcR et meurt à moins qu’elle
n’effectue un réarrangement productif de ses chaînes γ et δ. Toutefois,
contrairement aux cellules b, les thymocytes n’ayant pas effectué de
réarrangement productif VDJβ peuvent être sauvés grâce à l’organisation
particulière des gènes codant la chaîne β. En, effet, des réarrangements successifs
peuvent sauver la cellule d’un réarrangement β initialement non productif. Ce
phénomène se produit seulement si le premier réarrangement a impliqué des
segments D et J du locus Cβ1. Dans ce cas, un gène Vβ et un segment
DJ du locus Cβ2 se réarrangent, délétant par la même occasion le
locus Cβ1 et les gènes ayant généré un réarrangement non productif.
Ce mécanisme augmente considérablement la probabilité d’avoir un réarrangement
du gène des chaînes β du TcR.
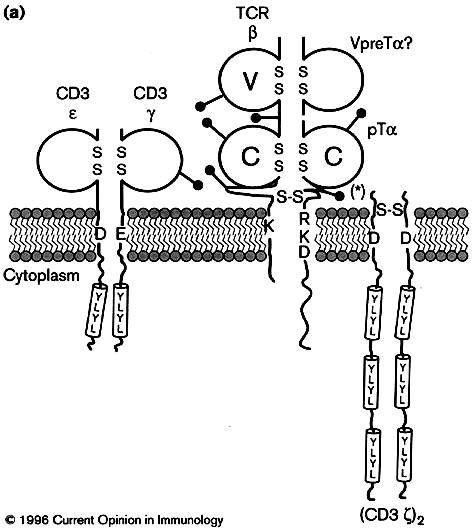
Lorsque la chaîne β du TcR est
convenablement réarrangée, elle s’exprime en surface associée à la chaîne préTá et aux
molécules CD3 pour former le pré-TcR. L’expression du pré-TCR induit la
phosphorylation et la dégradation de RAG-2. Ceci a pour conséquence l’arrêt des
réarrangements β.
Figure 5 : Structure du Pré-TcR.
Le rôle de l’expression de la
chaîne β dans l’exclusion allélique et l’arrêt d’autres réarrangements des
chaînes β est illustrée chez les souris transgéniques exprimant une chaîne β
réarrangée. Dans ce cas, toutes les cellules T expriment la chaîne β
transgénique et les réarrangements des chaînes β endogènes sont fortement
réprimés.
De manière concomitante, le
pré-TcR induit une rapide phase de prolifération ainsi que l’expression des
co-récepteurs CD4 et CD8 ; ces événements nécessitent la présence de la
protéine kinase p56 Lck. Durant cette phase de prolifération, les gènes RAG-1
et RAG-2 qui sont responsables du réarrangement des gènes du TCR sont fortement
réprimés. Ainsi, aucun réarrangement des chaînes α ne peut avoir lieu durant
cette phase. Ceci permet à la population double positive de se développer:
CD4+ et CD8+ ayant une chaîne β fonctionnelle et donc, d’avoir un nombre élevé
de cellules où les réarrangements α pourront se produire. En effet, lorsque la
phase de prolifération prend fin, les gènes RAG-1 et RAG-2 sont à nouveau
transcrits et les protéines RAG-1 et 2 s’accumulent dans la cellule. Chaque
cellule ayant une chaîne β peut alors réarranger ses chaînes α. Ainsi, une
chaîne β fonctionnelle peut être associée à un très grand nombre de chaînes α
différentes. Durant la période des réarrangements, les récepteurs αβ
s’expriment à la surface du thymocyte et la sélection thymique débute.
Figure 6 : Signaux intracellulaire induit par le Pré-TcR.
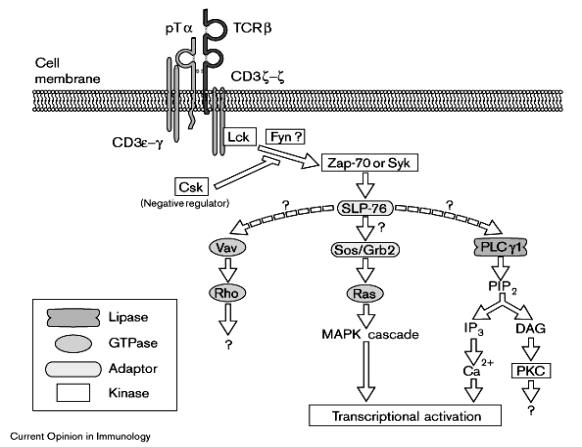
Figure 7 : Rôle du Pré-TcR.

D – 3 -
Réarrangement de la chaîne a.
Les gènes de la chaîne a
du TcR ressemblent aux gènes des chaînes légères κ et λ des immunoglobulines
dans le sens où il n'y a pas de gène D et que leur réarrangement débute après que
les chaînes lourdes (Ig) ou β (TcR) se soient exprimées à la surface de la
cellule.
Une différence majeure entre le
locus des chaînes légères des Ig et celui de la chaîne a du TcR
réside dans le grand nombre de segments Ja (61). Cette structure
particulière du locus a permet de multiples réarrangements successifs
jusqu’à l’obtention d’une chaîne a fonctionnelle. De plus,
la possibilité pour la cellule de réarranger sa chaîne a sur les
deux chromosomes garantit pratiquement à tout coup d’avoir une chaîne a
fonctionnelle exprimée sur tous les thymocytes en développement. Une des
conséquences de ce phénomène est qu’il n’est pas rare qu’un thymocyte exprime
un réarrangement fonctionnel sur ses deux chromosomes et que les deux chaînes a
produites s’associent avec la chaîne β à la surface de la cellule. En effet,
contrairement aux cellules B, l’expression d’un TcR aβ
fonctionnel n’induit
pas la répression des gènes RAG-1 et RAG-2 et donc l’arrêt des réarrangements
des chaînes a. La chaîne a du TcR n’est donc pas
soumise à l’exclusion allèlique. Le réarrangement des chaînes a cesse
lorsque la cellule est soumise à la sélection thymique positive. Toutefois,
seuls les TcR qui peuvent reconnaître des peptides antigéniques dans le
contexte CMH du soi sont sélectionnés positivement. Le contrôle des
réarrangements a par la sélection positive permet à la cellule T de
n’avoir qu’ une seule spécificité même si les deux chaînes a sont
exprimées.
Figure 8 : Réarrangement de la chaîne a.
III – Sélections positive et négative
A
– Introduction
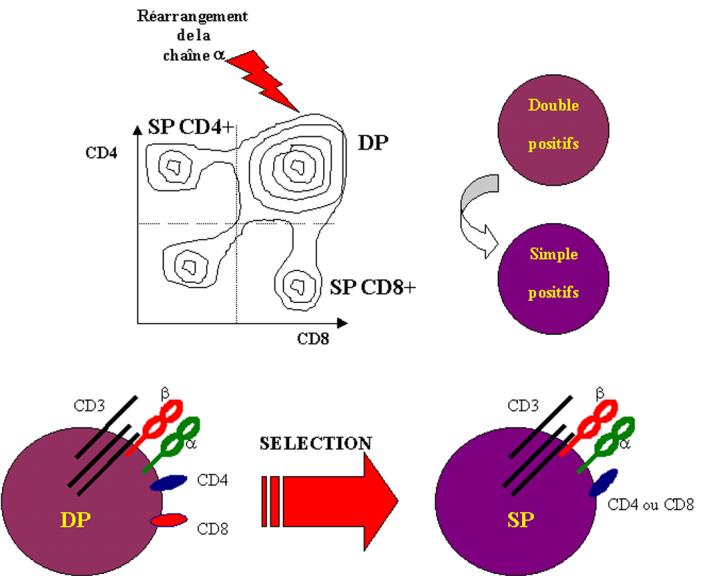
Au cours de leur maturation, les thymocytes immatures se
différencient en thymocytes double positifs exprimant le CD4, le CD8 et des
niveaux faibles de récepteur T. Ces cellules migrent dans le cortex vers la
jonction cortico-médullaire. Ces cellules double positives ont une durée de vie
courte (2 à 3 jours) si elles ne sont pas sauvées par l’engagement de leur TcR.
Le sauvetage des thymocytes double positifs de la mort cellulaire programmée
est appelée sélection positive et permet la maturation ultérieure des
thymocytes en cellules simple positives CD4+ ou CD8+. La
sélection positive permet la survie des thymocytes susceptibles de reconnaître
des peptides antigéniques étrangers présentés par des molécules du CMH
autologue. Les cellules double positives sont ensuite soumises à une sélection
négative. Les cellules dont les récepteurs reconnaissent les peptides du soi
avec une trop grande affinité seront éliminées. Le processus permet d’éliminer
les cellules auto-réactives.
Figure 9 : Sélection positive et négative dans le thymus
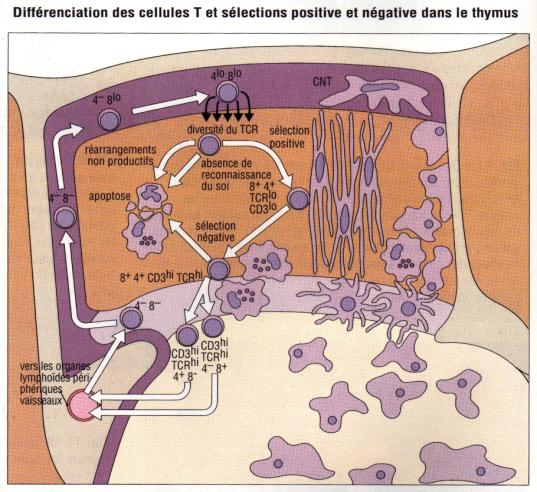
Photo : Immunologie clinique, 1991, J.
Brostoff. Ed DeBoeck Université
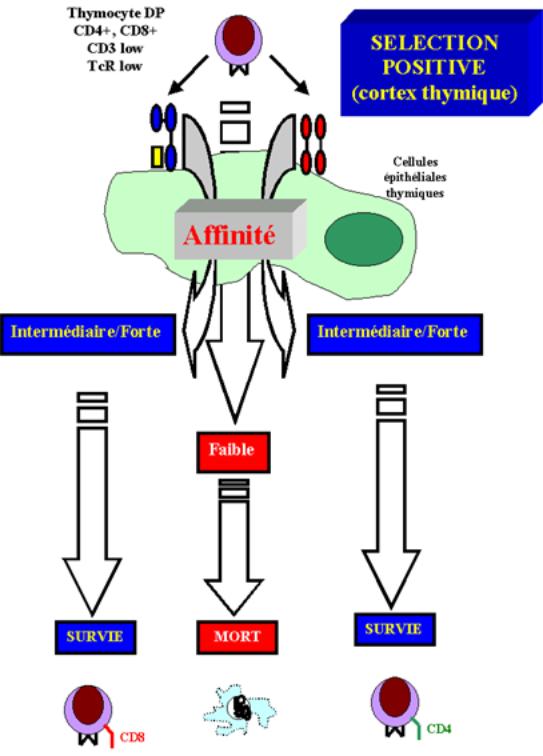
B - Sélection positive
La première démonstration de
l’existence d’une sélection thymique positive a été réalisée chez des souris
d’un génotype CMH particulier et irradiées chez qui des cellules médullaires
d’un autre CMH ont été injectées. L’irradiation détruit tous les lymphocytes et
les progéniteurs médullaires du receveur, si bien que toutes les cellules (lymphocytes
et CPA) qui dérivent de la moelle, proviennent du donneur. Le donneur utilisé
dans cette expérience était un hybride F1 CMHa x CMHb
alors que le receveur irradié était une souris d’haplotype CMHa ou
CMHb. Les cellules T de la souris CMHa x b peuvent être
stimulées par l’antigène présenté dans le contexte CMHa ou CMHb.
Si des cellules médullaires de ces souris hybrides CMHa x b sont
transférées à un receveur irradié d’haplotype CMHa ou CMHb,
les cellules T qui maturent vont être sélectionnées positivement par le CMH
thymique du receveur. Lorsque ces animaux sont immunisés par un antigène,
l’antigène est présenté par les CPA dérivées de la moelle du donneur. Il peut
donc être présenté dans le contexte CMHa ou CMHb. On
s’aperçoit que les cellules T de ces animaux répondent en réalité à l’antigène
seulement quand il est présenté par des CPA du donneur exprimant l’haplotype du
receveur suggérant la disparition des cellules T exprimant l’autre haplotype.
Il est montré que la sélection positive est due à la délétion
des clones qui ne reconnaissent pas le CMH autologue dans le thymus.
Une seconde expérience a permis
de démontrer que le tissu responsable de la sélection positive était le stroma
thymique. La souris receveuse était une souris athymique (nude) greffée avec un
thymus de génotype MHCa. Lors du transfert de moelle de donneur MHC axb,
les cellules lymphoïdes de l’animal étaient porteuses à la fois du CMHa
et du CMHb. Là encore, seules les cellules T reconnaissant
l’antigène dans le contexte du MHCa porté par le thymus, étaient
capables de se développer. Les souris chimères utilisées pour démontrer le rôle
de la sélection positive thymique étaient capables de répondre à l’antigène. A
contrario, si on injecte de la moelle MHCa à un receveur irradié
CMHb, le receveur ne pourra pas répondre à une stimulation
antigénique puisque les cellules T seront sélectionnées dans le thymus pour
reconnaître des antigènes que dans le contexte MHCb et qu’elles ne
rencontreront en périphérie que des peptides présentés par des APC dérivant de
la moelle donc dans le contexte MHCa. Les cellules T ne pourront
plus reconnaître les antigènes présentés par leurs propres cellules
présentatrices. Les cellules T ne pourront être activées que si l’on injecte en
même temps que l’antigène, des APC d’haplotype MHCb. Ainsi, pour
qu’une greffe de moelle puisse reconstituer le statut immunitaire de l’animal,
il doit y avoir au moins une molécule de CMH commune entre le donneur et le
receveur. De telles considérations sont particulièrement importantes lors de
greffes allogéniques utilisées dans le traitement des hémopathies malignes.
Si les expériences précédentes
ont permis de mettre en évidence le rôle crucial du thymus dans la sélection
positive, des études plus détaillées ont nécessité l’utilisation d’animaux
transgéniques exprimant un TcR particulier. L’introduction de ce transgène chez
des souris ayant un fond génétique CMH déterminé a permis d’établir le rôle des
molécules du CMH dans la maturation des thymocytes reconnaissant tous le même
antigène. Ces études ont confirmé que les cellules T se développent seulement
si elles sont restreintes au CMH autologue.
Elles ont aussi permis d’étudier
le devenir des cellules T non sélectionnées positivement. Un transgène codant
un TcR spécifique d’un complexe CMH – peptide a été introduit chez une souris
ayant un haplotype CMH différent. Le devenir des cellules T a été suivi grâce à
un anticorps clonotypique spécifique du TcR transgénique. On a pu ainsi montrer
que les cellules qui ne reconnaissent pas le CMH du soi, ne maturent pas après
le stade double positif et meurent en trois ou quatre jours dans le thymus.
Dans un thymus normal, le devenir de chaque thymocyte dépend de la spécificité
de son TcR. La spécificité du TcR peut varier dans la mesure où les chaînes α
continuent de se réarranger. La capacité d’un thymocyte d’exprimer plusieurs
réarrangements de sa chaîne a augmente le nombre de thymocytes ayant un TcR
susceptible de réagir avec le CMH du soi. Les réarrangements continus des
chaînes a rendent possible l’expression par un nombre non
négligeable de lymphocytes de deux récepteurs T ayant une chaîne β commune mais
une chaîne a distincte. Ces cellules T exprimant deux
récepteurs spécifiques peuvent induire une réponse immunitaire inappropriée. La
régulation de l’expression des chaînes a par la sélection positive
fait que seul un des récepteurs est restreint par le CMH et est donc
fonctionnel sur la cellule T.
B – 1 - Rôle
des co-récepteurs CD4 et CD8 dans la sélection positive
Lors de la sélection positive, les thymocytes expriment à la fois les co-récepteurs CD4 et CD8. A la fin du processus sélectif, les thymocytes matures, avant leur départ du thymus vers la périphérie, n’expriment plus qu’un seul des deux co-récepteurs. De plus, toutes les cellules matures qui expriment le CD4 reconnaissent des peptides liés aux molécules de classe II du CMH et sont programmées pour devenir des cellules T auxiliaires, sécrétrices de cytokines, alors que les cellules T exprimant le CD8 reconnaissent des peptides liés aux molécules de classe I du CMH et sont programmées pour devenir des lymphocytes T cytotoxiques. De ce fait, la sélection positive détermine le phénotype de surface ainsi que le potentiel fonctionnel des cellules T matures en sélectionnant le co-récepteur approprié. Ainsi, c’est la spécificité du TcR pour la molécule de MHC du soi qui détermine quel co-récepteur la cellule T doit exprimer. Si le TcR reconnaît un peptide présenté par les molécules de classe I du CMH, les cellules exprimeront le co-récepteur CD8 alors que si le TcR reconnaît un peptide présenté par les molécules de classe II du CMH, les cellules exprimeront le co-récepteur CD4.
Le rôle de la molécule de CMH
dans ce processus sélectif peut être observé chez les individus ayant des
mutations dans les gènes codant les molécules de classe II du CMH. Chez ces
individus qui n’expriment pas les molécules de classe II sur leur épithélium
thymique, toutes les cellules T produites, possèdent le co-récepteur CD8. De
même, l’absence de molécule de classe I du CMH se traduit par l’absence de
cellule T exprimant le CD8.
Deux modèles sont proposés pour expliquer l’intervention des co-récepteurs CD4 et CD8 dans la sélection positive.
B – 1 –
1 - Modèle instructif
Les deux co-récepteurs induisent
des signaux intra-cellulaires distincts. L’engagement du TcR et de l’un ou
l’autre des co-récepteurs exprimés par le thymocyte double positif induit un
signal qui réprime la synthèse du co-récepteur non initialement engagé.
B – 1 – 2
- Modèle stochastique / sélectif
La sélection du co-récepteur se
fait en deux étapes. La première correspond à l’engagement initial du TcR et de
la modulation au hasard de l’un ou l’autre des co-récepteurs. Puis une étape de
sélection conduit à l’élimination des thymocytes ayant modulé le co-recepteur
inadéquat.
Figure 10 : Intervention des co-récepteurs dans la sélection positive

B – 2 - Rôle
des cellules du cortex épithélial thymique dans la sélection positive
Le rôle des cellules thymiques dans la modulation des co-récepteurs a été mis à profit pour déterminer la nature des cellules impliquées dans la sélection positive. Le rôle des cellules épithéliales corticales thymiques dans ce processus sélectif a été mis en évidence dans une série d’expériences utilisant des souris génétiquement modifiées n’exprimant plus de molécules de classe II sur leur épithélium thymique.
Ces souris ne peuvent pas
produire de lymphocytes T CD4 alors que les lymphocytes T CD8 se développent
normalement. Si on introduit chez ces animaux un transgène codant une molécule
de classe II du CMH dont l’expression est restreinte à l’aide d’un promoteur
spécifique des cellules épithéliales thymiques, les cellules T CD4 maturent
normalement. Une seconde expérience a montré que la molécule de CMH de classe
II devait pouvoir interagir avec le co-récepteur CD4 pour permettre la bonne
maturation des lymphocytes T CD4. En effet, lorsque le transgène codant la
molécule de classe II dans le thymus comporte une mutation qui empêche sa
fixation sur la molécule de CD4, aucune cellule T CD4 ne se développe. Des
expériences similaires ont été réalisées pour les CD8 et les molécules de
classe I.
Figure 11 : Rôle des cellules du cortex épithélial thymique dans la
sélection positive.
C - Sélection négative
Lorsqu’un lymphocyte T mature reconnaît en périphérie un
complexe CMH-peptide à la surface d’une CPA, il s’active et prolifère. Au
contraire, la même interaction au niveau thymique entre un thymocyte
sélectionné positivement et un complexe CMH-peptide conduit à l’apoptose du
thymocyte.
Cette réponse à l’antigène au niveau central est la base
de la sélection négative. Ce phénomène a été démontré chez des souris exprimant
un récepteur T transgénique spécifique d’un peptide de l’ovalbumine présenté
dans le contexte des molécules de classe II du CMH. L’injection d’ovalbumine
aux animaux induit l’activation et la prolifération des lymphocytes T
périphériques alors que la plupart des thymocytes meurent dans le même temps
par apoptose. Chez une souris normale, les thymocytes rencontrent dans le
thymus un large éventail de peptides du soi fixés sur les molécules du CMH à la
surface des cellules thymiques. La reconnaissance d’un tel complexe par le TcR
du thymocyte conduit à l’élimination de la cellule.
La délétion des cellules T qui
reconnaissent des peptides du soi dans le thymus peut être démontrée
expérimentalement chez des souris transgéniques exprimant un TcR spécifique
d’un peptide présent seulement chez les animaux mâles (antigène H-Y). Les
thymocytes exprimant le récepteur tansgénique sont éliminés au stade double
positif chez les mâles alors que ces mêmes cellules se développent normalement
chez les femelles.
Ces
expériences illustrent le principe que les complexes CMH-peptides du soi
présents dans le thymus purgent le répertoire T des cellules ayant un récepteur
autoréactif. Toutefois, toutes les protéines du soi ne sont pas exprimées dans
le thymus. Des protéines du soi exprimées seulement en périphérie ou à partir
d’un certain stade du développement (à la puberté par exemple) peuvent
rencontrer en périphérie des cellules susceptibles de réagir avec ces
constituants. L’absence de réponse vis à vis de ces protéines suggère qu’il existe
d’autres mécanismes en périphérie qui préviennent l’induction d’une réponse T
vis à vis de tels antigènes.
Figure 11 : sélection négative.
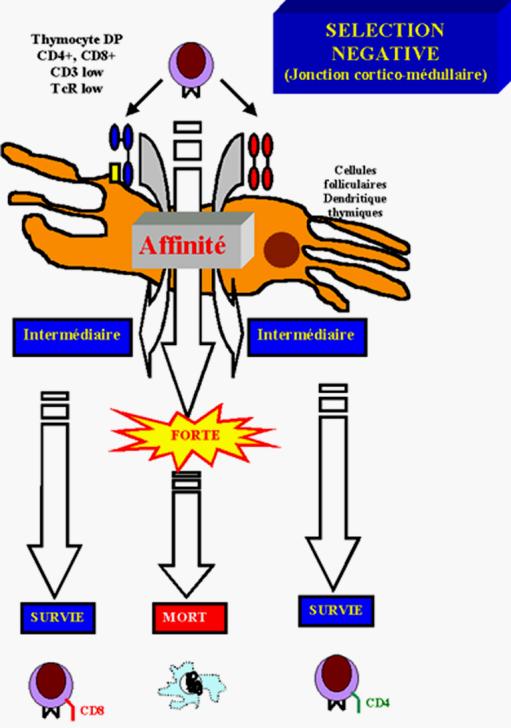
C – 1 - Cellules responsables de la sélection négative
Alors que les cellules épithéliales du cortex thymique sont responsables de la sélection positive, la sélection négative peut être médiée par de nombreux types cellulaires. Les macrophages et les cellules dendritiques dérivées de la moelle semblent être les cellules les plus impliquées dans la sélection négative.
Leur rôle a été mis en évidence
dans des expériences de greffe de moelle de souris MHC a b chez des
receveurs d’haplotype MHC a. Chez les animaux receveurs, les
cellules T qui maturent dans le thymus reconnaissent les cellules épithéliales
thymiques exprimant le MHC a et les macrophages et les cellules
dendritiques dérivant de la moelle exprimant le MHC axb. La greffe
d’un tissu exprimant le MHC b sur les souris chimères reconstituées
avec de la moelle MHC a b n’est pas rejetée. Ce résultat implique
que les cellules T dont le récepteur reconnaît le MHC b ont été
délétées dans le thymus. Comme les cellules MHC axb dérivées de la
moelle sont les seules sources de molécules de MHC b dans le thymus,
les cellules dérivées de la moelle doivent être capables d’induire la sélection
négative. Bien que les CPA dérivées de la moelle soient les principales
cellules responsables de la sélection négative, les cellules épithéliales et
les thymocytes eux-mêmes peuvent induire la délétion des thymocytes
auto-réactifs.
D – Couplage de la sélection positive et de la sélection négative
Les cellules T sont sélectionnées dans le thymus sur leur restriction au CMH et sur leur capacité de reconnaître des antigènes étrangers. Les cellules T immatures sont positivement sélectionnées de sorte que seuls les thymocytes dont les récepteurs reconnaissent un complexe CMH-peptide du soi présent sur les cellules du cortex épithélial thymique poursuivent leur maturation. La sélection négative élimine les thymocytes dont les récepteurs reconnaissent un complexe CMH-peptide du soi présenté par des CPA professionnelles. On peut se demander pourquoi, au cours de la sélection positive, les lymphocytes survivent grâce à l'engagement de leur TcR, alors qu'ils en meurent au cours de la sélection négative. La réponse à cette question n’est pas formellement tranchée mais deux mécanismes ont été proposés pour expliquer ce phénomène.
La première hypothèse repose sur la différence d’avidité des récepteurs. Le devenir d’une cellule T reconnaissant un complexe CMH-peptide via son TcR dépend de l’intensité du signal délivré par le TcR. L’intensité du signal dépend de l’affinité du TcR pour le complexe CMH-peptide et de la densité du complexe sur les cellules épithéliales du cortex thymique. Les thymocytes dont le signal est faible sont sauvés de la mort cellulaire et sont ainsi positivement sélectionnés, les thymocytes dont le signal est fort sont éliminés et donc sélectionnés négativement. La proportion des thymocytes reconnaissant des complexes CMH-peptide avec une avidité faible étant plus élevée que la proportion des thymocytes reconnaissant les complexes avec une avidité forte, il en résulte que le répertoire sélectionné positivement est plus large que celui sélectionné négativement.
La deuxième hypothèse est celle du signal différentiel. Dans ce cas, c’est la nature du signal délivré par le récepteur plutôt que le nombre de récepteurs engagés qui distingue la sélection positive de la sélection négative. Dans l’hypothèse de l’avidité, un même complexe CMH-peptide peut être sélectionné positivement ou négativement en fonction de sa densité à la surface des cellules thymiques. Cet aspect quantitatif n’est pas pris en compte dans l’hypothèse du signal différentiel où au contraire, la sélection dépend de la qualité des signaux induits par le TcR.
La découverte du caractère
antagoniste de certains peptides a permis de tester cette hypothèse. Les
peptides antagonistes sont des variants des peptides naturellement présentés
dans un contexte CMH particulier. La différence entre les peptides naturels et
antagonistes réside dans la substitution d’un acide aminé. Si l’interaction du
TcR avec le complexe CMH-peptide naturel induit l’activation de la cellule T,
la même interaction avec le complexe CMH-peptide antagoniste conduit au blocage
de la cellule T. Les peptides antagonistes délivrent en fait un signal partiel
à la cellule T. L’activation cellulaire qui en découle est donc limitée. Ces
signaux pourraient s’apparenter à ceux observés au cours de la sélection
positive. Cette hypothèse a pu être testée en utilisant des lobes thymiques de
souris transgéniques pour un TcR particulier. L’incubation des lobes thymiques
avec un peptide non reconnu par le TcR prévient la sélection positive et
conduit à l’élimination des thymocytes. L’utilisation du peptide naturel induit
la délétion des thymocytes par sélection négative. L’utilisation d’un peptide
antagoniste, reconnu par la cellule T transgénique mais ne délivrant qu’un signal
partiel, permet la sélection et le développement des thymocytes. Toutefois, ces
expériences suggèrent qu’il existe des différences dans la sélection des
lymphocytes T CD4+ et CD8+. En effet, dans ce système, l’utilisation de
peptides antagonistes permet la sélection des lymphocytes T CD8+ alors que dans
les mêmes conditions, les lymphocytes T CD4+ ne sont pas sélectionnés. D’autres
expériences ont montré que le seuil d’activation nécessaire à la sélection des
lymphocytes T CD4+ était plus élevé que celui nécessaire à la sélection des
lymphocytes T CD8+ et qu’un tel seuil ne pouvait être atteint que si le TcR
était engagé en même temps que son co-récepteur. Ces expériences impliquent
donc que la sélection des lymphocytes T CD8+ peut être opérée lorsque le TcR
des thymocytes se fixe sur un complexe CMH-peptide produisant un signal faible
ou partiel alors que la sélection des lymphocytes T CD4+ nécessite la fixation
concomitante du TcR et de l’un ou l’autre des co-récepteurs présents à la
surface du thymocyte double positif.
IV - Tolérance périphérique
A – Définitions et principes de base du contrôle de la réponse
immune en périphérie
Les lymphocytes B et T générés au niveau des organes lymphoïdes primaires gagnent ensuite les ganglions périphériques. Le processus de sélection centrale a éliminé la très grande majorité des lymphocytes auto-réactifs. Toutefois malgré ce processus, on retrouve en périphérie un certain nombre de cellules potentiellement autoréactives. Ainsi, dans les ganglions périphériques coexistent deux populations lymphocytaires :
· · Des lymphocytes B et T reconnaissant des Ag étrangers
· · Des lymphocytes B et T reconnaissant des Ag du soi
En périphérie, seuls les premiers peuvent réagir, les
lymphocytes autoréactifs sont quant à eux contrôlés par différents mécanismes.
L’ensemble de ces mécanismes est appelé : tolérance périphérique.
Le déclenchement de la réponse immune en périphérie est un
phénomène qui procède par étape. A chacune de ces étapes il existe des points
de contrôle qui permettent ou non à la réponse immune de ce produire.
B – La
théorie des co-signaux
L’activation du lymphocyte T spécifique de l’antigène nécessite deux signaux membranaires.
1. 1. La reconnaissance TcR/CMH-peptide
2. 2. L’intervention de co-signaux de stimulation (co-signaux)
C’est cette interaction qui induit la spécificité de la réponse T.
B –1 Signaux de costimulation
Le récepteur T a comme fonction de convertir un événement extracellulaire en une série de signaux intracellulaires activateur. Le TcR n’a qu’une très courte région intracytoplasmique incapable de générer ces signaux activateurs. Ce rôle de transduction du signal est assuré par le CD3. Les chaînes intracellulaires du CD3 vont ainsi subir des phosphorylations qui vont finalement conduire à l’activation du lymphocyte T. Cette activation se traduit par des mouvements de calcium intracellulaire, l’activation de facteurs de transcription (NF-KB, AP-1 par exemple) et donc à la synthèse de protéines impliquées dans la croissance et la maturation de la cellule.
B
–1 - 1 La molécule B-7
B-7 est présent sur les cellules présentatrices de l’antigène.
Seules les cellules dendritiques expriment B-7 à leur membrane de façon constitutive. Les autres CPA expriment B-7 lorsqu’elles sont activées. Le rôle de B-7 s’étend donc à l’ensemble des CPA. B-7 a un rôle essentiel dans l’activation de la réponse T. B-7 existe sous deux formes B-7.1 et B-7.2.
Il existe sur le lymphocyte T deux ligands de B-7.
1. 1. CD28
Rôle dans la régulation positive de l’activation du lymphocyte T:
Activation B-7/CD28 : synthèse d’IL-2.
Rôle dans la différenciation Th1/Th2.
Interaction CD28/B-7.1 : différenciation du lymphocyte T en Th1.
Interaction CD28/B-7.2 : différenciation du lymphocyte T en Th2.
2. 2. CTLA-4
Se fixe aussi bien sur B-7.1 et B-7.2.
Homologue de CD28 mais différences dans la région intracytoplasmique.
CTLA-4 délivre un signal inhibiteur sur l’activation du lymphocyte T.
B –1– 2
CD40/CD40 Ligand
Expression et structure
1. 1. CD40
Exprimé de façon constitutive par les lymphocytes B, CD40 est aussi retrouvé sur les macrophages, les cellules dendritiques, les cellules épithéliales et endothéliales.
CD40 est une protéine trans-membranaire de la famille du TNF.
2. 2. CD40 Ligand
Exprimé sur les lymphocyte T 2 à 4 heures après leur activation. Diminue 48 heures après l’activation.
Exprimé par les Th1 et les Th2.
Fait aussi partie de la famille du TNF
Peut être exprimé sur d’autres types cellulaire selon les circonstances : Lymphocytes B, Mastocytes, Basophiles, Eosinophiles.
Rôle :
Transduction de signaux activateurs au lymphocyte B.
Induction des molécules de co-stimulation B-7.1 et B-7.2.
Formation des centres germinatifs.
Sélection de mutants de haute affinité pour l’Ag.
Rôle dans la commutation
isotypique.
B –2 Contrôle de la réponse immunitaire
B –2 –1
Défaut de costimulation : rôle de B-7 : ANERGIE
La reconnaissance en périphérie d’un complexe CMH/peptide/TcR ou d’un complexe Ig de surface/Ag en l’absence de co-signaux de stimulation induit l’anergie du lymphocyte. Cette anergie se traduit par un état de non réponse du lymphocyte concerné. Le lymphocyte ne prolifère pas ni ne sécrète de l’IL-2 en présence de l’Ag. On dit que son récepteur de l’antigène est désensibilisé. On peut même observer dans certains cas une diminution de l’expression des récepteurs de l’antigène à la surface du lymphocyte.
Ainsi, le déclenchement ou non de la réponse immune dépend de l’expression à la surface des cellules présentatrices de l’Ag de l’expression de molécules de costimulation ainsi que de la synthèse par les CPA activées de cytokines immunostimulantes. On comprend donc que le déclenchement de la réponse immune est intimement lié à l’activation de la cellule présentatrice de l’antigène.
Dans le cas d’une agression du système immunitaire par un pathogène, il se produit une inflammation locale propice à l’activation de la cellule présentatrice. Dans ces conditions, celle-ci exprime des molécules de co-stimulation à sa surface et synthétise des cytokines immunostimulantes comme l’IL-12.
Dans
le cas d’un auto-antigène, les peptides sont présentés associés aux molécules
de classe I et II du CMH à la surface de très nombreuses APC. Toutefois, cette
présentation a lieu en l’absence de toute activation de la cellule
présentatrice. Les lymphocytes T auto-réactifs reconnaîtront donc bien des
complexes CMH/peptide via leur TcR mais cette reconnaissance s’effectuera en
l’absence de co-stimulation. L’anergie des lymphocytes T induite par ce
mécanisme explique aussi l’état de non réponse observé au niveau des
lymphocytes B. En effet une réponse B à un antigène thymo-dépendant implique la
coopération d’un lymphocyte T spécifique de l’antigène. Ce lymphocyte T
autoréactif étant dans un état d’anergie, il ne peut plus fournir au lymphocyte
B les cosignaux nécessaires au développement de la réponse B.
Figure 12 : Théorie des co-signaux, mécanisme de l’anergie.
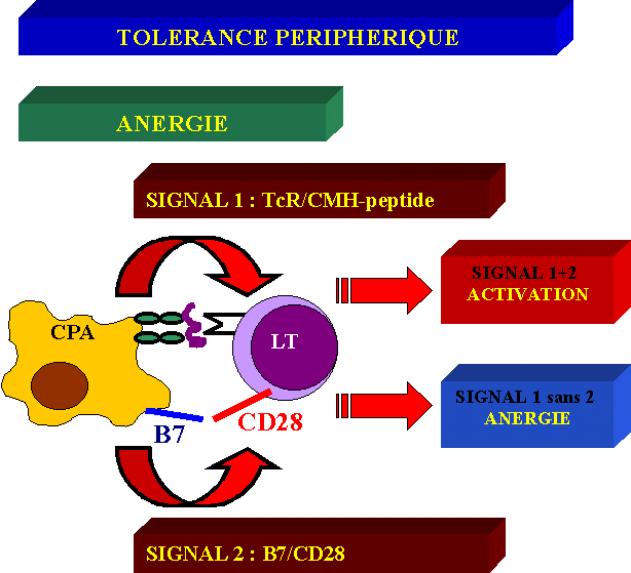
B –2 –2 Elimination
des lymphocytes B autoréactifs : rôle de CD40
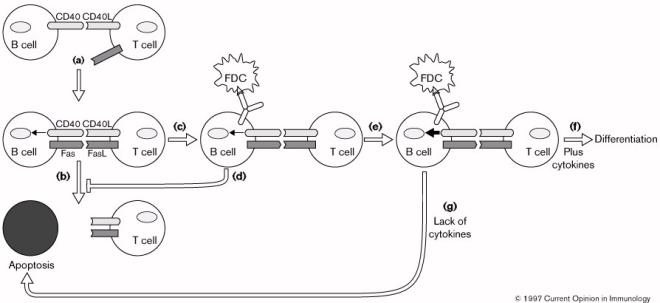
Les interactions entre CD40, Fas et les signaux induits
par l’activation du BcR déterminent le devenir du lymphocyte B: l’activation ou
la mort. (a) l’engagement de CD40 sur la cellule B par CD40L présent sur
la cellule T activée conduit à l’activation de la cellule B, et par l’induction
de l’expression de Fas à la surface du lymphocyte B. (b) l’interaction
entre Fas et FasL présent sur la cellule T activée induit l’apoptose de
la cellule B permettant ainsi l’arrêt de la réponse immune. (c) Lorsque
le BcR est activé simultanément avec CD40 et Fas, l’apoptose médiée par Fas est
inhibée (d) de plus (e) l’activation de la cellule B via CD40 est
augmentée. (f) cette augmentation d’activation en présence de cytokines,
conduit à la différenciation de la cellule B. (g) Des interactions
membranaires en l’absence de cytokines aboutit à la mort de la cellule par
apoptose. Dans ce modèle, on comprend bien qu’une cellule B est normalement
programmée pour mourir, seul l’engagement du BcR fournit les signaux
nécessaires à la survie du lymphocyte B. Dans le cas de cellules B
auto-réactives, la désensibilisation du BcR ne peut permettre, lorsque celui-ci
se lie à son antigène, l’activation optimale du lymphocytes B. Les signaux
produits dans ce cas sont trop faibles pour sauver le lymphocytes B de
l’apoptose. Ce mécanisme permet dons d’éliminer en périphérie les lymphocytes B
auto-réactifs.
Figure 12 : Elimination des lymphocytes B auto-réactifs, rôle de CD40.
C - Théorie
géographique
Cette théorie admet le principe suivant : La réponse immune est régulée par l’antigène seul. La réponse dépend donc uniquement
· De la localisation de l’Ag
· De la dose d’Ag présent
- Du temps pendant lequel l’Ag est présent
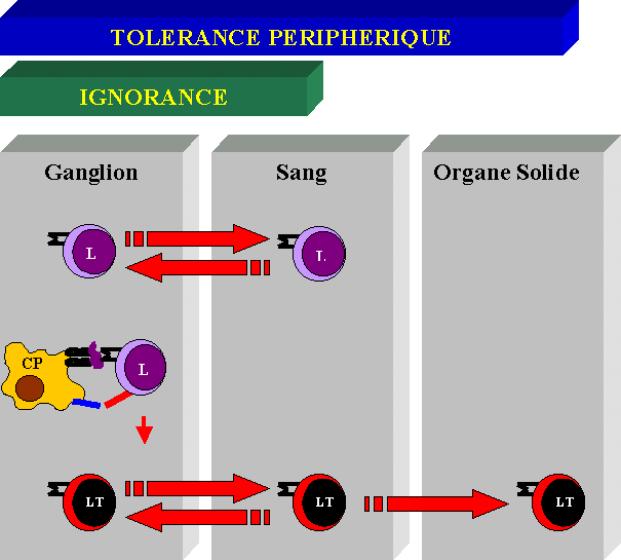
C –1 Localisation de l’antigène
Les cellules immuno-compétentes accomplissent leurs fonctions individuellement, toutefois, leur activation dépend de leurs rencontres et de leurs coopérations au sein de structures particulières : les organes lymphoïdes.
Ces structures anatomiques définissent
· La localisation de l’Ag
· Les contacts intercellulaires
· L’environnement cytokinique
Dans ces conditions, les CPA captent et présentent l’Ag de façon optimale à des lymphocytes T. Les chances de trouver un lymphocyte T spécifique sont élevées.
· Les ganglions périphériques accueillent des Ag transportés par des cellules dendritiques via la circulation afférente des organes solides
· La rate fonctionne comme un filtre ou des Ag solubles ou particulaires sont captés à partir du sang circulant.
· Les organes solides périphériques sont des tissus dont l’organisation diffère de celle des organes lymphoïdes secondaires. Les cellules dendritiques présentes au sein de l’organe ne font pas partie de celui-ci. Elles migrent du tissu vers les organes lymphoïdes transportant les Ag du soi et du non-soi.
A l’intérieur de ce système, les lymphocytes migrent en fonction de leur état d’activation.
· Les lymphocytes T naïfs circulent dans le sang, la rate, les ganglions mais ne migrent jamais en périphérie.
· Les lymphocytes T activés peuvent eux migrer dans les tissus et notamment au niveau des sites inflammatoires.
Lors d’une infection, la porte d’entrée est périphérique. Les antigènes infectieux gagnent le ganglion afférent en 1 à 3 jours et là, après un délai de quelques jours, se disséminent dans tout l’organisme. L’antigène peut être localisé soit dans un ganglion soit dans un organe périphérique mais dans ce cas, il doit migrer vers le ganglion transporté par une cellule présentatrice de l’Ag .
Les antigènes présents hors des organes lymphoïdes sont immunologiquement ignorés. Cette règle s'applique aussi aux antigènes qui sont présents trop peu de temps ou en trop faible quantité. On peut retrouver ce phénomène dans certaines situations pathologiques
Virus
o Rage dans les neurones
o Papilloma virus dans les kératinocytes
o Tumeurs épithéliales
Figure 13 : Ignorance immunitaire.
Expériences
illustrant le rôle de la localisation de l’Ag
1) Cas du virus de la rage
Le
virus de la rage infecte les neurones. Lorsque ceux-ci sont détruits,
l’antigène est pris en charge par les CPA qui le conduisent vers les organes
lymphoïdes secondaires où va se déclencher une réponse immune B et T.
Naturellement, cette induction est trop lente pour sauver l’hôte (virus trop
peu cytopathogène). On peut toutefois stimuler l’immunité en vaccinant par un
virus tué après l’innoculation.
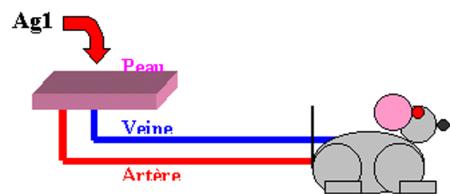
2) Rôle du transport de l’antigène : expérience des "skin flaps"
La
réponse immunitaire vis à vis de l’antigène se développe si les vaisseaux
lymphatiques drainant sont intacts : Les CPA chargées en antigène doivent
migrer dans le ganglion afférent afin de sensibiliser les lymphocytes T.
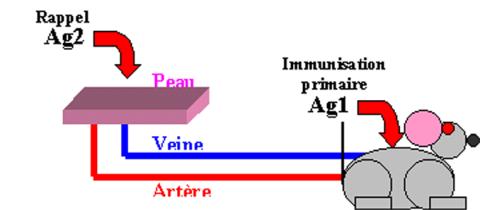
La réponse immunitaire
vis à vis de l’antigène se développe même sans vaisseaux lymphatiques. Une fois
sensibilisés, les lymphocytes T recirculent par la grande circulation et
migrent dans les tissus.
3) Modèle des souris RIP-LCMV
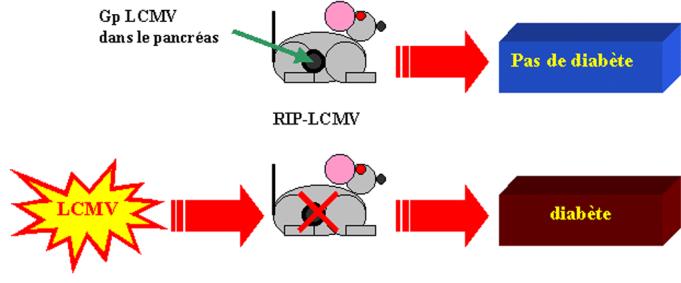
C –2 Dose et persistance de l’antigène
L’antigène doit persister assez longtemps (3à 6 jours) dans le ganglion pour induire une réponse.
Les antigènes présents en permanence dans les organes lymphoïdes délètent la réponse T spécifique. Ceci vaut aussi pour les Ag transportés de façon continue dans les organes lymphoïdes par les CPA.
Cette règle s’applique:
1. Aux Ag du soi (tolérance au soi)
2. Aux Ag étranger si
o Ils pénètrent rapidement dans les organes lymphoïdes
o En quantité abondante
o Ils persistent
Expériences
illustrant le rôle de la dose et de la persistance de l’Ag
1) Modèle RIP-LCMV
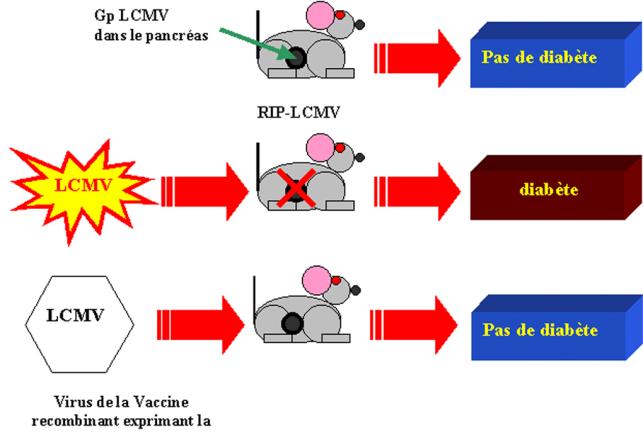
2) Réponse immunitaire contre un antigène soluble : injection IV d’albumine bovine
De tels antigènes ne peuvent induire de réponse car même s'ils
sont donnés à des doses élevées et qu’ils gagnent les ganglions périphériques,
leur demi-vie est trop courte pour induire une réponse.
3) Induction totale et élimination de la réponse T (AICD)
L’infection de souris par un Ag présent partout dans l’organisme, à forte dose et pendant assez longtemps (1 à 3 jours) induit la délétion de la réponse T.
Exemple : infection de souris déficientes en IFN par des doses massives de LCMV. On observe dans ce cas une dissémination massive du virus dans tout l’organisme. Il s’ensuit une induction rapide de tous les précurseurs qui une fois activés vont mourir en deux à trois jours. Cette mort va causer une délétion clonale des cellules T spécifiques de l’antigène. La réponse restera délétée si le virus persiste et gagne le thymus. Ce mécanisme d’induction totale puis de la mort des précurseurs lymphocytaire est appelé AICD pour " antigen induced cell death ".
Ce mécanisme explique la tolérance du système immunitaire aux antigènes du soi. En effet, Ils sont eux aussi présent en grande quantité et persistent dans l’organisme.
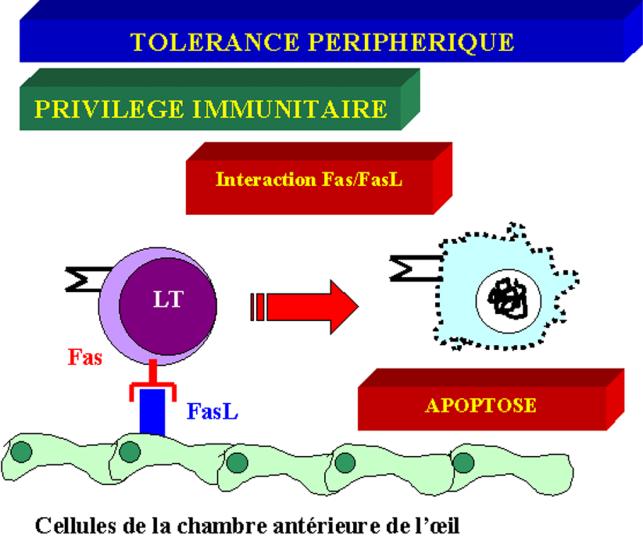
C – 3
Privilège immunitaire
Certains organes sont dits
« immunologiquement privilégiés » parce qu’ils sont protégés de
l’inflammation et des dommages colatéraux associés à une réponse immunitaire
forte. Parmi les sites immunologiquement privilégiés, on trouve les cellules de
la chambre antérieure de l’œil, les cellules de Sertoli et, dans une moindre
mesure, le cerveau. Si le concept d’organe immunologiquement privilégié a plus
de 100 ans, les mécanismes moléculaires expliquant les caractéristiques
particulières de ces sites ont été mis à jour récemment. Definis à l’origine
comme des sites où des greffes tissulaires allo- ou xénogéniques étaient
tolérées, ces sites étaient considérés comme protégés du système immunitaire
par des barrières physiques limitant la diffusion des antigènes du site vers
les organes lymphoïdes secondaires et empêchant l’accès au site des cellules
effectrices activées. Bien que ces obstacles physiques jouent un rôle non
négligeable dans la protection de ces organes contre une agression du système
immunitaire, d’autres mécanismes plus actifs comme la production locale de
cytokines et de neuropeptides immunomodulateurs, l’expression faible des
molécules de classe I et II du CMH, la synthèse de protéines inhibitrices du
complément, peuvent conférer aussi à certains organes leur statut privilégié.
Des études récentes, montrant que ces sites exprimaient constitutivement FasL,
ont apporté une dimension nouvelle à ce concept de privilège immunitaire. Dans
l’œil, l’expression constitutive de FasL permet le contrôle de la prolifération
des cellules lymphoïdes exprimant Fas qui pénètrent dans cet organe au cours
d’une infection virale. L’expression de FasL protège les cellules de Sertoli
des rejets allo- et xénogéniques lorsqu’elles sont transplantées sous la
capsule rénale du receveur.
Figure 13 : Privilège immunitaire.